Pressemitteilungen
zurück
Bluttests in der Tumordiagnostik- zirkulierende Tumorzellen (CETC / CTC) und zirkulierende Tumor-DNA (ctDNA)
Unter einer Flüssigbiopsie (Liquid Biopsy) versteht man die Entnahme und Untersuchung von Körperflüssigkeiten wie Blut, Urin, Spinalflüssigkeit und Pleura oder Peritonealexsudat mit dem Ziel, Krankheiten zu diagnostizieren oder zu überwachen. Dieses Vorgehen gewinnt insbesondere in der Onkologie zunehmend an Bedeutung, da maligne Tumoren ganze Zellen, zellfreie Tumor-DNA, Exosomen und andere Bestandteile in das umgebende Gewebe oder in den Blutkreislauf freisetzen.
Tumorzellen(CETC / CTC) und TumorDNA(ctDNA) können im Blut zirkulieren und ihre Analyse kann wertvolle Hinweise auf den Tumor und dessen Aktivität liefern-ganz ohne die Notwendigkeit einer invasiven Gewebeentnahme im Rahmen einer klassischen Biopsie. Aus pathologischer Sicht ist der Begriff Flüssigbiopsie im Zusammenhang mit dem Nachweis von ctDNA jedoch nicht ganz korrekt, da es sich hierbei um rein molekularanalytische Verfahren handelt und nicht um eine Biopsie im traditionellen, pathologischen Sinne.
Was sind zirkulierende Tumorzellen und zirkulierende Tumor-DNA?
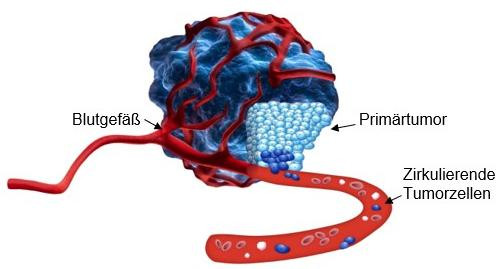 Eine besondere Untergruppe bilden zirkulierende Tumorzellen mit stammzellähnlichen Eigenschaften, sogenannte zirkulierende Tumorstammzellen (cCSCs). Sie spielen eine entscheidende Rolle bei der Metastasierung und dem Krankheitsverlauf, da sie sich in verschiedene Zelltypen differenzieren können und selbst nach Jahren noch zu einem Rückfall (Rezidiv) führen können.
Eine besondere Untergruppe bilden zirkulierende Tumorzellen mit stammzellähnlichen Eigenschaften, sogenannte zirkulierende Tumorstammzellen (cCSCs). Sie spielen eine entscheidende Rolle bei der Metastasierung und dem Krankheitsverlauf, da sie sich in verschiedene Zelltypen differenzieren können und selbst nach Jahren noch zu einem Rückfall (Rezidiv) führen können.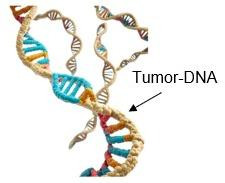 Zirkulierende Tumor-DNA(ctDNA) bezeichnet DNA-Fragmente unterschiedlicher Länge, die aus Tumorzellen stammen und im Blut nachgewiesen werden können. Wenn Tumorzellen entweder im Tumor oder solche, die sich bereits vom Tumor abgelöst haben absterben, wird ihre DNA in den Blutkreislauf freigesetzt. Die genetischen Veränderungen des ursprünglichen Tumors können in diesen Fragmenten enthalten sein. Damit ctDNA gezielt nachgewiesen und überwacht werden kann, müssen die relevanten Mutationen zuvor im Primärtumor identifiziert worden sein. ctDNA ist Bestandteil der im Blut vorhandenen zellfreien DNA(cfDNA), die größtenteils aus dem Abbau normaler Körperzellen, insbesondere Blutzellen, stammt. Da der Anteil von ctDNA an der gesamten cfDNA jedoch sehr gering ist, sind für ihren zuverlässigen Nachweis besonders hochsensitive molekulare Analyseverfahren erforderlich
Zirkulierende Tumor-DNA(ctDNA) bezeichnet DNA-Fragmente unterschiedlicher Länge, die aus Tumorzellen stammen und im Blut nachgewiesen werden können. Wenn Tumorzellen entweder im Tumor oder solche, die sich bereits vom Tumor abgelöst haben absterben, wird ihre DNA in den Blutkreislauf freigesetzt. Die genetischen Veränderungen des ursprünglichen Tumors können in diesen Fragmenten enthalten sein. Damit ctDNA gezielt nachgewiesen und überwacht werden kann, müssen die relevanten Mutationen zuvor im Primärtumor identifiziert worden sein. ctDNA ist Bestandteil der im Blut vorhandenen zellfreien DNA(cfDNA), die größtenteils aus dem Abbau normaler Körperzellen, insbesondere Blutzellen, stammt. Da der Anteil von ctDNA an der gesamten cfDNA jedoch sehr gering ist, sind für ihren zuverlässigen Nachweis besonders hochsensitive molekulare Analyseverfahren erforderlichWie werden zirkulierende Tumorzellen und zirkulierende Tumor-DNA nachgewiesen?
Die Potenziale und Einschränkungen im Vergleich
| Zirkulierende Tumorzellen | Zirkulierende Tumor-DNA | |
| CETC / CTC maintrac® | CTC CellSearch™ | |
Potenziale:
| Potenziale:
| |
|
| |
Einschränkungen:
| Einschränkungen:
| |
Klinische Relevanz zirkulierender Tumorzellen und zirkulierender Tumor-DNA.
Die klinische Bedeutung von zirkulierenden Tumorzellen und zirkulierender TumorDNA nimmt in der modernen Onkologie stetig zu. Beide Liquid Biopsy-Komponenten liefern Informationen über das Tumorgeschehen und ermöglichen eine nicht-invasive, dynamische Überwachung der Krebserkrankung. Während CETCs/CTCs als intakte Zellen wertvolle Einblicke in zelluläre Eigenschaften und funktionelle Merkmale des Tumors bieten - etwa durch Immunphänotypisierung oder Wirkstofftestungen - erlaubt ctDNA einen basenspezifischen molekulargenetischen Blick auf Tumormutationen.Pachmann GmbH&Co.KG(n.d.) .maintrac® and stemtrac®, abgerufen 05.06.2025,
https://www.maintrac.de
Menarini Silicon Biosystems(n.d.) .CTC CellSearch™, abgerufen 05.06.2025,
https://www.cellsearchctc.com
Bauer, E.ctDNA-Status als neuer Prognosemarker?, Fokus Onkol 28, 42(2025).
https://doi.org/10.1007/s15015-025-4173-6
Zhang, Y., Reduzzi, C., Gerratana, L., &Cristofanilli, M.(2025) .Circulating tumor cell isolation and enrichment technologies.In C.Reduzzi, L.Gerratana, &M.Cristofanilli(Eds.) , International review of cell and molecular biology(Vol.392, pp.119–149) .Academic Press.
https://doi.org/10.1016/bs.ircmb.2025.01.009
Andree KC, van Dalum G, Terstappen LW.Challenges in circulating tumor cell detection by the CellSearch system.Mol Oncol.2016 Mar;10(3) :395-407.doi:10.1016/j.molonc.2015.12.002.Epub 2015 Dec 25.PMID:26795350;PMCID:PMC5528971
Barradas, A.M.C., &Terstappen, L.W.M.M.(2013) .Towards the Biological Understanding of CTC:Capture Technologies, Definitions and Potential to Create Metastasis.Cancers, 5(4) , 1619-1642.
https://doi.org/10.3390/cancers5041619
Coumans, F., Terstappen, L.(2015) .Detection and Characterization of Circulating Tumor Cells by the CellSearch Approach.In:Kroneis, T.(eds) Whole Genome Amplification.Methods in Molecular Biology, vol 1347.Humana Press, New York, NY.
https://doi.org/10.1007/978-1-4939-2990-0_18
Wang, L., Balasubramanian, P., Chen, A.P., Kummar, S., Evrard, Y.A., &Kinders, R.J.(2016) .Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells.Seminars in oncology, 43(4) , 464–475.
https://doi.org/10.1053/j.seminoncol.2016.06.004
Gold, M., Pachmann, K., Kiani, A., &Schobert, R.(2021) .Monitoring of circulating epithelial tumor cells using the maintrac® method and its potential benefit for the treatment of patients with colorectal cancer.Molecular and Clinical Oncology, 15, 201.
https://doi.org/10.3892/mco.2021.2363
Pachmann, K.(2015) .Current and potential use of MAINTRAC method for cancer diagnosis and prediction of metastasis.Expert Review of Molecular Diagnostics, 15(5) , 597-605.
https://doi.org/10.1586/14737159.2015.1032260
Pizon, M., Schott, D., Pachmann, U., &Pachmann, K.(2016) .The number of tumorspheres cultured from peripheral blood is a predictor for presence of metastasis in patients with breast cancer.Oncotarget, 7(30) , 48143–48154.
https://doi.org/10.18632/oncotarget.10174
W.Jeffrey Allard, Jeri Matera, M.Craig Miller, Madeline Repollet, Mark C.Connelly, Chandra Rao, Arjan G.J.Tibbe, Jonathan W.Uhr, Leon W.M.M.Terstappen;Tumor Cells Circulate in the Peripheral Blood of All Major Carcinomas but not in Healthy Subjects or Patients With Nonmalignant Diseases.Clin Cancer Res 15 October 2004;10(20) :6897– 6904.
https://doi.org/10.1158/1078-0432.CCR-04-0378
Qureshi, Zaheer MD;Altaf, Faryal MD;Khanzada, Mikail MD;Safi, Adnan MD;Asghar, Zoha MD;Warraich, Daniyal MD;Shah, Shivendra MD.Liquid biopsies for early detection and monitoring of cancer:advances, challenges, and future directions.Annals of Medicine&Surgery 87(6) :p 3244-3253, June 2025.doi:10.1097/MS9.0000000000002776

